Хусаинов Н.О., научный сотрудник, врач травматолог-ортопед ФГБУ «Научно-исследовательский детский ортопедический институт им. Г.И. Турнера» Минздрава России, Санкт-Петербург.
Синдром Дауна — самая распространенная генетическая аномалия с частотой встречаемости 1 на 660 новорожденных [1]. Помимо характерных фенотипических признаков у пациентов наблюдают ряд проблем со стороны многих органов и систем: сердечно-сосудистой, нервной, пищеварительной, эндокринной, опорно-двигательной [2]. Повышение качества медицинской помощи привело к увеличению средней продолжительности жизни пациентов, многие из них хотят заниматься спортом хотя бы на любительском уровне, поэтому врачам любых специальностей, участвующим в наблюдении и лечении пациентов данной нозологической группы, необходимо иметь представление о проблемах их костно-мышечной системы.
К патологии опорно-двигательного аппарата относят: мышечную гипотонию [3, 4], кранио-цервикальную и атланто-аксиальную нестабильность (ААН) [5-7], сколиоз и спондилолистез [8-14], нестабильность тазобедренного сустава [15-18], вальгусную деформацию нижних конечностей на уровне коленных суставов, нестабильность надколенника [19], плоскостопие и деформации первого луча стопы [20].
Одной из наиболее значимых ортопедических проблем является патология краниовертебральной области, представленная нестабильностью в сегментах череп-первый шейный позвонок и между первым и вторым шейными позвонками и (реже) различными вариантами дисплазии краниовертебральной зоны (гипо-/аплазия зубовидного отростка, зубовидная кость, ассимиляция атланта), осложненных развитием краниоцервикальной нестабильности [22, 23]. Частота встречаемости данной патологии составляет, по данным разных авторов, 10%-60% [5, 24], в зависимости от критериев, определяющих понятие «нестабильность». Первое описание в литературе относится к 1961 году [25].
Значимость проблемы определяется сравнительно высоким риском развития неврологических нарушений, связанных с компрессией спинного мозга, в процессе занятий контактными видами спорта и проведения медицинских манипуляций (интубация трахеи) [26]. В литературе описан случай внезапного развития клиники тетрапареза с нарушением функции тазовых органов у ребенка 13 лет с синдромом Дауна после проведения инстилляции глазных капель [27]. Симптоматический вариант нестабильности наблюдают у 1-2% пациентов [24]. Об актуальности данной патологии свидетельствует тот факт, что еще в 1984 году Американская Академия Педиатрии разработала рекомендации по проведению обследования детей с синдромом Дауна, желающих принимать участие в контактных видах спорта [28]. В 1983 году Специализированный Комитет Олимпийских Игр ввел протокол обследования спортсменов с синдромом Дауна перед участием в соревнованиях, включающий выполнение функциональных рентгенограмм шейного отдела в боковой проекции [29].
Клиническими проявлениями симптоматической формы атланто-аксиальной нестабильности являются: чувство дискомфорта и болей в шейном отделе позвоночника, внезапно развившаяся кривошея, нарушения походки и функции тазовых органов, снижение ручной умелости, спастичность мышц нижних конечностей, гиперрефлексия. Возникновение данной симптоматики диктует необходимость проведения инструментального обследования пациента. Рентгенологическими признаками наличия патологии являются: увеличение атланто-дентального интервала (ADI) более 5 мм, базиллярно-дентального расстояния более 12 мм, значения индекса Power более 1.0 (передняя атланто-окципитальная нестабильность), либо менее 0.55 (задняя атланто-окципитальная нестабильность) [12, 30, 31] (Рис.1). Также для атланто-окципитальной нестабильности характерно увеличение амплитуды переднезадней трансляции черепа, оцениваемой по методу Weisel et al., более 2 мм. – данная методика считается более точной, чем метод Power [32, 33] (Рис.1).
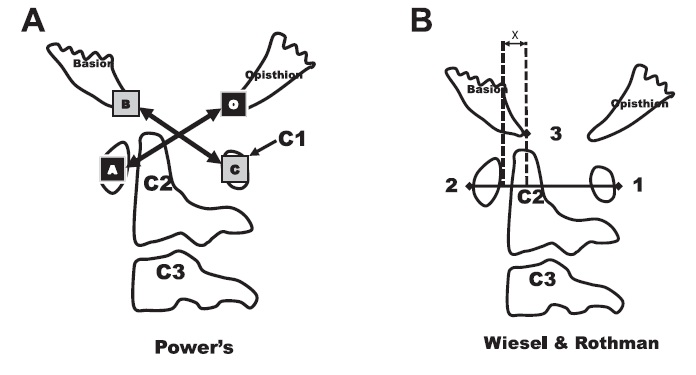
Рисунок 1. (A) Индекс Power. Вычисление проводят по формуле: ВС/АО. Значение > 1.0 свидетельствует о наличии атланто-окципитальной нестабильности. (B) Метод Wiesel и Rothman. Проводят измерение величины Х на функциональных рентгенограммах. Нормальное значение < 1.0 мм.
О возможном наличии компрессии спинного мозга свидетельствуют: увеличение атланто-дентального интервала более 10 мм, уменьшение размера резервного пространства для спинного мозга (SAC) менее 13 мм и нарушение “правила трех Still”[1] – в таких случаях показано проведение магнитно-резонансной томографии для определения истинной величины стеноза и состояния спинного мозга [34-36]. Проведение компьютерной томографии позволяет верифицировать виды дисплазии краниоцервикальной зоны: различные варианты ассимиляции атланта, зубовидную кость, гипо- и аплазию зубовидного отростка, - а также дифференцировать врожденные состояния от последствий травмы этой области, что иногда бывает довольно затруднительным [37].
Одной из причин развития нестабильности принято считать повышенную эластичность поперечной связки атланта (lig. transversum) [38], связанную с дисплазией соединительной ткани, обусловленной аномальным строением коллагена вследствие наличия трех копий гена COL6A1 и COL6A2. В некоторых случаях разрыва/острой декомпенсации этой связки сохранившиеся крыловидные связки (lig. alaria) остаются основными удерживающими структурами и ограничивают переднюю трансляцию атланта, и тогда клинические проявления ограничены дискомфортом или болями, умеренными проявлениями миелопатии. Разрыв крыловидных связок ведет к полной дестабилизации сегмента С1-С2 и, как следствие, риску развития компрессии спинного мозга, сопровождающейся тяжелыми неврологическими нарушениями [39]. Доказано, что даже незначительная травма или инфекционный процесс носоглоточной области и среднего уха может привести к развитию ААН [40, 41]. Аномалии развития костных структур, которые у людей с синдромом Дауна наблюдаются несколько чаще, чем в других группах пациентов: гипоплазия мыщелков затылочной кости, ассимиляция атланта, зубовидная кость, гипо- и аплазия зубовидного отростка, - также могут служить причиной развития нестабильности [24, 42]. Исследование, в котором проведено сравнение данных компьютерной томографии, свидетельствует о том, что размер пространства для спинного мозга у пациентов с синдромом Дауна меньше, чем в популяции (505 mm2 и 602 mm2, соответственно), потому, даже минимальная сублюксация может приводить к развитию симптомов. Наличие гипоплазии С1 у пациентов данной группы может служить причиной развития стеноза позвоночного канала даже при незначительном увеличении атланто-дентального интервала (около 6 мм) [43, 44]. Известно, что подобные аномалии развития выявляют при проведении патологоанатомического исследования новорожденных с подтвержденным диагнозом синдрома Дауна [45]. Отличительной особенностью в таких случаях является возможное развитие не только передне-задней, но и боковой нестабильности. С этим фактом связана сравнительно большая тяжесть и частота неврологических проявлений и, как следствие, более агрессивный подход в проведении хирургического лечения пациентов данной группы.
На данный момент необходимость профилактического проведения стабилизирующих операций при наличии асимптоматической формы краниоцервикальной нестабильности не признана [46]. Большинство существующих длительных наблюдений свидетельствуют о том, что по мере взросления происходит спонтанная стабилизация сегмента С1-С2 [Alvarez N, 2004 неопубликованные данные]. Стоит отметить, что в ряде случаев отмечают ухудшение имеющейся ситуации, а также развитие симптоматической формы нестабильности у лиц, ранее не имевших клинических или рентгенологических ее признаков [47]. Критерии перехода симптоматической формы в асимптоматическую и наоборот - отсутствуют. Показаниями к проведению различных вариантов хирургического вмешательства, включающих в себя стабилизацию различной протяженности и проведение как передней, так и задней декомпрессии спинного мозга, являются: наличие неврологических проявлений, обусловленных компрессией спинного мозга; наличие рентгенологических признаков явной механической ААН (увеличение атланто-дентального интервала более 10 мм) [28], уменьшение резервного пространства для спинного мозга менее 13 мм, нарушение “правила трех Still”; некоторые нестабильные формы дисплазии краниоцервикальной зоны (зубовидная кость), атланто-окципитальная нестабильность, базиллярная импрессия [24]. При отсутствии клинических проявлений и наличии только такого рентгенологического признака ААН, как увеличение атланто-дентального интервала в пределах от 5 до 10 мм, показано исключение участия ребенка в контактных видах спорта, осторожное проведение медицинских манипуляций, регулярное проведение рентгенологического обследования (1 раз в год).

Многие авторы сообщают о довольно высокой частоте (до 70% - 100%) [48, 49] развития осложнений при проведении хирургического лечения: отсутствие формирования костного блока (до 50%) [50], дестабилизация металлоконструкции, неврологические нарушения [51], летальный исход [48 52, 53]. Кроме того, лишь у малого количества пациентов (около 20%) наблюдают регресс неврологического дефицита [48].
Помимо краниовертебрального перехода существует опасность развития миелопатии на уровне средне- и нижне-шейного отделов позвоночника, обусловленной дегенеративно-дистрофическими изменениями (снижение высоты межтелового пространства, рост остеофитов, дестабилизация сегментов) [54, 55]. Особенностью является их появление у пациентов молодого возраста (старше 20 лет) [56]. Maclachlan с соавторами (1993) обнаружили что у пациентов с синдромом Дауна наиболее часто поражены именно С2-С6 сегменты, при этом С5+/- С6 сегменты — более всего [57]. Данные Fidone (1986) свидетельствуют о том, что дегенеративно-дистрофические изменения шейного отдела позвоночника обнаруживаются у половины пациентов в возрасте от 30 до 40 лет и у 100% пациентов старше 40 лет [58]. Эти процессы обуславливают развитие вторичного стеноза позвоночного канала и, как следствие, неврологической симптоматики. Поэтому, в отличие от пациентов детского возраста, у лиц старше 20 лет при наличии клинических проявлений миелопатии (нарушение походки/функции тазовых органов, спастичность мышц нижних конечностей) следует, в том числе, исключать дегенеративно-дистрофическое поражение сегментов шейного отдела [59].
Частота встречаемости сколиоза у пациентов с синдромом Дауна составляет 7-9% [8, 9]. Сравнительно большая частота, возможно, объясняется тем, что нередко заболевание является ятрогенным вследствие проведения стерно- и торактомии при выполнении оперативных вмешательств на сердце [9-11]. Тактика лечения не отличается от таковой при ведении других пациентов с идиопатическим сколиозом: наблюдение при наличии деформации до 25 градусов, корсетотерапия при наличии деформации от 25 до 40 градусов и оперативное лечение при наличии деформации величиной более 45 градусов[2].
Хирургическое лечение состоит в проведении коррекции и стабилизации деформации различными видами спинальных металлоконструкций, но связано с несколько большей частотой развития осложнений как в раннем (пневмония, длительное заживление ран, инфекционные осложнения), так и в позднем (дестабилизация металлоконструкции, формирование псевдоартроза) послеоперационных периодах. Проведение консервативного лечения с применением корсета может быть затруднительным вследствие отказа пациентов соблюдать жесткий режим его ношения и потому, как правило, неэффективно [9]. Таким образом, поддержание физической активности, контроль массы тела и, по возможности, занятия лечебной физкультурой по программам, разработанным для пациентов со сколиотической болезнью, являются приоритетными направлениями.
Спондилолиз и спондилолистез. Точная частота встречаемости у пациентов с синдромом Дауна неизвестна, хотя некоторые авторы предполагают, что она должна быть выше, чем в общей популяции, ввиду повышенной эластичности связочного аппарата и большей частоты пороков развития костных структур у этих пациентов [12]. Данные Hansdorfer с соавторами подтверждают это предположение: в их исследовании частота встречаемости спондилолиза и спондилолистеза составила 18.7% и 32.7%, соответственно [13]. Наличие жалоб на боли в поясничном отделе позвоночника, в мышцах-сгибателях голени, уплощение поясничного лордоза, нарушение походки, функции тазовых органов могут являться симптомами заболевания. Тактика лечения заключается в проведении наблюдения и выполнении упражнений лечебной физкультуры при стабильных формах спондилолистеза и хирургической стабилизации при большой степени смещения (III-IV по Meirding), прогрессирующих формах или в случае безуспешности проведения консервативного лечения [14].

Патология тазобедренного сустава заключается в наличии нестабильности бедра, которую связывают с мышечной гипотонией, повышенной эластичностью связочного аппарата; сравнительно высокой частотой встречаемости эпифизеолиза головки бедренной кости [60], возможно связанной с особенностями эндокринной системы; пространственным нарушением положения вертлужной впадины — ретроверзии с формированием дефицита заднего покрытия [61]. Лечение пациентов с нестабильностью тазобедренного сустава на фоне синдрома Дауна зависит от клинико-рентгенологической картины и возраста пациента. Описаны 4 основные стадии развития этого состояния [62]. Начальная (возраст ребенка 0-2 года - до начала ходьбы): клинически определяют повышенную мобильность бедра, рентгенологических признаков патологии нет. В эту фазу необходимо следить за удержанием бедра во впадине. Фаза дислокации (возраст 2 — 8 лет): характерно возникновение вывихов бедра при определенных движениях. Повторные и частые дислокации приводят к развитию вторичных изменений со стороны вертлужной впадины. Поэтому важно не только добиваться вправления бедра, но и предотвращать ситуации, ведущие к возникновению вывиха. Фаза формирования подвывиха бедра (возраст 8 - 15 лет): вследствие частых дислокаций развиваются вторичные изменения вертлужной впадины в виде уменьшения площади покрытия головки бедра; отмечают хромоту и боли при ходьбе. Показано проведение хирургических вмешательств, направленных на восстановление соотношения компонентов сустава и стабилизацию бедра путем выполнения, как правило, внесуставных корригирующих остеотомий. Фаза вывиха (старше 15 лет): бедро дислоцировано, параартикулярные ткани изменены, часто формируется неоартроз. Отмечают укорочение конечности, ограничение амплитуды движений, боли и хромоту. Объем оперативного вмешательства зависит от клинико-рентгенологической картины и длительности существования вывиха и может заключаться в выполнении как вне- и внутрисуставных вмешательств, так и тотального эндопротезирования. Проведение эндопротезирования тазобедренного сустава у пациентов с синдромом Дауна в последнее время проводят все чаще в связи с увеличением продолжительности их жизни. Однако, оно связано с большей частотой развития осложнений в послеоперационном периоде, таких как инфекция мочевыводящих путей и пневмония [63]. Частота встречаемости юношеского эпифизеолиза головки бедренной кости и болезни Пертеса у пациентов с синдромом Дауна составляет 1.3% и 2%, соответственно [64]. Характерной особенностью является позднее выявление заболевания ввиду трудностей в установлении продуктивного контакта с пациентами — мало кто из них предъявляет жалобы и способен описать характеристику боли (локализация, иррадиация, условия появления, длительность). Лечение аналогично лечению пациентов в общей популяции, но отличительной чертой является высокая частота развития осложнений (длительное заживление раны, инфекционные осложнения, асептический некроз головки бедра). Таким образом, поводом для обращения к ортопеду могут служить: нарушение походки в виде хромоты, избыточной наружной ротации нижних конечностей; боли; укорочение конечности; ограничение амплитуды движений в тазобедренном суставе; «ощущение вывихивания» бедра — щелчок, хруст. Во время занятий спортом или лечебной физкультурой следует с осторожностью выполнять любые упражнения, связанные с приведением бедра и его чрезмерной внутренней или наружной ротацией.

Патология со стороны коленных суставов встречается почти у 30 - 40% пациентов с синдром Дауна [65]. Вальгусная деформация на уровне коленных суставов, не превышающая пределы допустимых значений, является нормой для ребенка в возрасте до 6-8 лет [66]. Ввиду повышенной эластичности капсулы и коллатеральных связок коленного сустава, у пациентов с синдромом Дауна возможно развитие боковой нестабильности, которая усугубляет видимую «деформацию», при отсутствии истиной деформации оси кости. В таких случаях оперативное лечение не принесет желаемый результат, и приоритетом должно явиться физическое воспитание ребенка, обучение правильной ходьбе и контролю положения тела в пространстве. Нестабильность надколенника у пациентов данной группы наблюдают в 20% случаев и также связывают с мышечной гипотонией и повышенной эластичностью связок, иногда с недоразвитием бедренного компонента [67]. Однако, данные работы Rebouc с соавторами свидетельствуют о том, что дисплазия мыщелков бедренной кости не носит характер врожденной (как считалось ранее), а является следствием нестабильности надколенника, что диктует необходимость проведения профилактики рецидивов вывиха у этих пациентов [68]. Применение специальных фиксирующих надколенник ортезов может быть полезным. В редких случаях показано проведение хирургического лечения, направленного на центрацию надколенника в межмыщелковой борозде и нормализацию баланса мышц, окружающих коленный сустав, так как длительно существующая рецидивирующая нестабильность неизбежно приведет к раннему развитию остеоартроза и ухудшению функции передвижения.
Патология стоп в виде мобильной плано-вальгусной деформации стопы, деформации первого или пятого лучей, как правило, не вызывает у пациентов трудностей [21, 67]. Необходим лишь правильный подбор обуви для предотвращения хронической травматизации мягких тканей стопы. Иногда у пациентов в возрасте от 2 до 5 лет наблюдают дислокацию сухожилий мышц малоберцовой группы: последние смещаются на переднюю поверхность голеностопного сустава - данное состояние не влияет на ходьбу и не приносит пациентам дискомфорт [69]. Профилактическое применение ортопедической обуви, ортезов для стоп (стелек) у детей с синдромом Дауна не приводит к улучшению формы стопы, но мешает ее нормальному функционированию и развитию. Потому акцент следует делать на занятиях спортом и контроле массы тела [70].
Отдельно следует выделить такое заболевание, как «артропатия при синдроме Дауна». Впервые данное состояние было описано в 1984 году [71] у 6 детей с синдромом Дауна и клиникой ювенильного ревматоидного артрита. На данный момент в литературе существует описание лишь 30 случаев [2, 72-75]. Частота встречаемости, по данным большинства авторов, составляет 1.2%. До сих пор ведутся споры о природе этого состояния: является ли оно сочетанием синдрома Дауна и ювенильного ревматоидного артрита, либо оно уникально и характерно только для этих пациентов в свете данных о большей частоте встречаемости у них аутоимунных заболеваний. Отличительными особенностями являются: длительная бессимптомная стадия, прогрессирующее течение и полиартикулярный вариант поражения, осложненный формированием подвывихов компонентов суставов. Лечение данного состояния — прежде всего медикаментозное и должно проводиться под контролем ревматолога [67].
Протокол обследования и ведения пациента с синдромом Дауна при подозрении на наличие патологии краниовертебральной зоны.
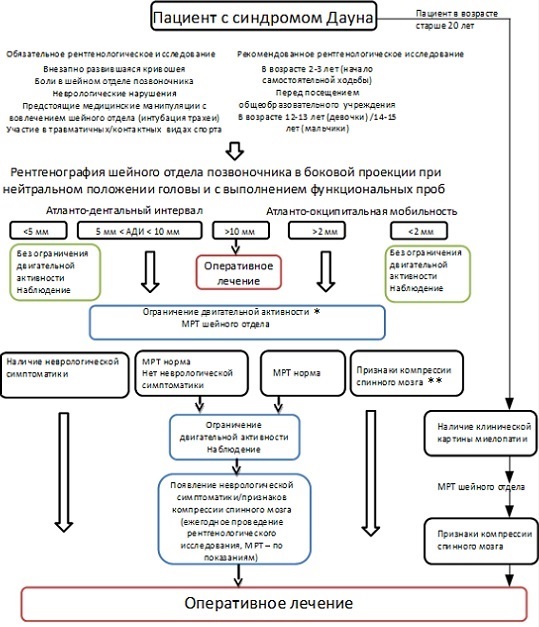
Рисунок 2. Протокол обследования и ведения пациента с синдромом Дауна при подозрении на наличие патологии краниовертебральной зоны.
* Исключение участия в контактных видах спорта, осторожное проведение манипуляций с шейным отделом.
** Отсутствие компрессии спинного мозга, миеломаляции, ликвородинамических нарушений.
Литература:
- Ferguson R.L., Putney M.E., Allen Jr. B.L. Comparison of neurologic deficits with atlanto-dens intervals in patients with Down syndrome // Journal of spinal disorders . 1997. Vol. 10, № 3. P. 246-252.
- Olson J.C., Bender J.C., Levinson J.E., et al. Arthropathy of Down syndrome // Pediatrics. 1990. Vol. 86. P. 931-936.
- Morris A.F., Vaughan S.E., Vaccaro P. Measurements of neuromuscular tone and strength in Down's syndrome children // Journal of Mental Deficiency Research. 1982. Vol. 26, № 1. P. 41-46.
- Pitetti K.H., Climstein M., Mays M.J., et al. Isokinetic arm and leg strength of adults with Down syndrome: a comparative study // Archives of Physical Medicine and Rehabilitation. 1992. Vol. 73, № 9. P. 847-850.
- Tredwell S.J., Newman D.E., Lockitch G. Instability of the upper cervical spine in Down syndrome // Journal of Pediatric Orthopaedics. 1990. Vol. 10, № 5. P. 602-606.
- Uno K., Kataoka O., Shiba R. Occipitoatlantal and occipitoaxial hypermobility in Down syndrome // Spine. 1996. Vol. 21, № 12. P.1430-1434.
- Matsuda Y., Sano N., Watanabe S., et al. Atlanto-occipital hypermobility in subjects with Down's syndrome // Spine. 1995. Vol. 20, № 21. 2283-2286.
- Lerman J.A., Emans J.B., Hall J.E., et al. Spinal arthrodesis for scoliosis in Down syndrome // Journal of Pediatric Orthopaedics. 2003, Vol. 23. P. 159-161.
- Milbrandt T.A., Johnson II C.E. Down syndrome and scoliosis: a review of a 50-year experience at one institution // Spine. 2005. Vol. 30, № 18. P.2051-2055.
- Reckles L.N., Peterson H.A., Weidman W.H., Bianco A.J. Jr. The association of scoliosis and congenital heart defects // The Journal of Bone & Joint Surgery PG. 1975. Vol. 57. P. 449–455.
- Bal S., Elshershari H., Celiker R., Celiker A. Thoracic sequels after thoracotomies in children with congenital cardiac disease // Cardiology in the young. 2003. Vol. 13. P. 264–267.
- Dimar J.R., Carreon L.Y. Spinal Deformity in Down Syndrome // Spine Deformity Preview Issue. 2012. P. 75-84.
- Hansdorfer M. A., Mardjetko S.M., Knott P.T., Thompson S.E. Lumbar Spondylolysis and Spondylolisthesis in Down Syndrome: A Cross-sectional Study at One Institution // Spine Deformity. 2013. Vol. 1, № 5. P. 382-388.
- Bridwell K.H. Surgical treatment of high grade spondylolisthesis // Neurosurgery Clinics of North America. 2006. Vol. 17. P. 331-338.
- Shaw E.D., Beals R.K. The hip joint in Down's syndrome. A study of its structure and associated disease // Clinical Orthopaedics and Related Research. 1992. Vol. 278. P. 101-107.
- Bennet G.C., Rang M., Roye D.P., et al. Dislocation of the hip in trisomy 21 // The Journal of Bone and Joint Surgery. 1982. Vol. 64, № 3. P. 289-294.
- Hresko M.T., McCarthy J.C., Goldberg M.J. Hip disease in adults with Down syndrome // The Journal of Bone and Joint Surgery. 1993. Vol. 75, № 4. P. 604-607.
- Dietz F.R., Albanese S.A., Katz D.A., et al. Slipped capital femoral epiphysis in Down syndrome // Journal of Pediatric Orthopaedics. 2004. Vol. 24, № 5. P. 508-513.
- Diamond L.S., Lynne D., Sigman B. Orthopedic disorders inpatients with Down’s syndrome // Orthopedic Clinics of North America.1981. Vol. 12, № 1. P. 57–71.
- Prasher V.P., Robinson L., Krishnan V.H., et al. Podiatric disorders among children with Down syndrome and learning disability // Developmental Medicine and Child Neurology. 1995. Vol. 37, № 2. P. 131-134.
- Concolino D., Pasquzzi A., Capalbo G., et al. Early detection of podiatric anomalies in children with Down syndrome // Acta Paediatrica. 2006. Vol. 95, № 1. P. 17-20.
- Губин А.В., Ульрих Э.В. Синдромальный подход к ведению детей с пороками развития шейного отдела позвоночника // Хирургия позвоночника. 2010, № (3). С.14–19.
- Ветрилэ С.Т., Колесов С.В. Краниовертебральная патология. М.: Медицина, 2007.
- Pizzutillo P.D., Herman M.J. Cervical spine issues in Down syndrome // Journal of Pediatric Orthopaedics. 2005, Vol. 25. P. 253–259.
- Spitzer R., Rabinowitch J.Y., Wybar K.C. A study of the abnormalities of the skull, teeth and lenses in mongolism // Canadian Medical Association Journal. 1961. Vol. 84. P. 567–672.
- Saad K.F. A lethal case of atlantoaxial dislocation in a 56-year-old woman with Down's syndrome // Journal of Intellectual Disability Research. 1995. Vol. 39 № 5. P. 447-449.
- Nucci P., Pellegrin M., Brancata R. Atlantoaxial Dislocation Related to Instilling Eyedrops in a Patient With Down's Syndrome // American Journal of Ophtalmology. 1996. Vol. 122, № 6. P. 908-909.
- American Academy of Pediatrics. Committee on Sports Medicine. Atlantoaxial instability in Down Syndrome // Pediatrics. 1984. Vol. 74, №1. P. 152-154.
- Goldberg M.J. Spine instability and the Special Olympics // Clinics in Sports Medicine. 1993. Vol. 12. P. 507-515.
- Pueschel S.M., Scola F.H., Tupper T.B., Pezzullo J.C. Skeletal anomalies of the upper cervical spine in children with Down syndrome // Journal of pediatric orthopedics. 1990. Vol. 10. P. 607-611.
- Powers B., Miller M.D., Kramer R.S., et al. Traumatic anterior atlanto-occipital dislocation // Neurosurgery. 1979. Vol. 4, № 1. P. 12-17.
- Wiesel S., Kraus D., Rothman R.H. Atlanto-occipital hypermobility // Orthopedic Clinics of North America. 1978. Vol. 9. P.969-972.
- Karol L.A., Sheffield E.G., Crawford K., et al. Reproducibility in the measurement of atlanto-occipital instability in children with Down syndrome // Spine. 1996. Vol. 21. P. 2463-2467.
- Lustrin E. S. Pediatric cervical spine: normal anatomy, variants, and trauma // RadioGraphics. 2003. Vol. 23. P. 539–560.
- Swischuk L. Imaging of the Cervical Spine in Children. - Springer, 2004. – 141 p.
- The Cervical Spine, 4th Edition / ed. by C. R. Clark. – Lippincott Williams and Wilkins, 2004. – 1250 p.
- Miller J.D., Capusten B.M., Lampard R. Changes at the base of skull and cervical spine in Down syndrome // Canadian Association of Radiologists Journal. 1986. Vol. 37, № 2. P. 85-89.
- Merrick J., Ezra E., Josef B., Hendel D., Steinberg D.M., Wientroub S. Musculoskeletal problems in Down Syndrome European Paediatric Orthopaedic Society Survey: the Israeli sample // Journal of Pediatric Orthopaedics B. 2000. Vol. 9, № 3. P. 185-192.
- Konttinen Y., Santavirta S. Atlantoaxial instability in Down’s syndrome // British Medical Journal. 1987. Vol. 294. P. 1549.
- Davidson R.G. Atlantoaxial instability in individuals with Down syndrome: a fresh look at the evidence // Pediatrics. 1988. Vol. 81, № 6. P. 857-865.
- Yamazaki M., Someya Y., Aramomi M., Masaki Y., Okawa A., Koda M. Infection-related atlantoaxial subluxation (Grisel syndrome) in an adult with Down syndrome // Spine. 2008. Vol. 33, № 5. P.156-160.
- Browd S., Healy L.J., Dobie G., et al. Morphometric and qualitative analysis of congenital occipitocervical instability in children: implications for patients with Down syndrome // Journal of Neurosurgery: Pediatrics. 2006. Vol. 105, № 1. P. 50-54.
- White K.S., Ball W.S., Prenger E.C., et al. Evaluation of the craniocervical junction in Down syndrome: correlation of measurements obtained with radiography and MR imaging // Radiology.1993. Vol. 186. P. 377 – 382.
- Matsunaga S., Imakiire T., Koga H., et al. Occult spinal canal stenosis due to C-1 hypoplasia in children with Down syndrome // Journal of Neurosurgery: Pediatrics. 2007. Vol. 107, № 6. P. 457-459.
- Frost M., Huffer W.E., Sze C.I., et al. Cervical spine abnormalities in Down syndrome // Clinical Neuropathology. 1999. Vol 18, № 5. P. 250-259.
- Winell J., Burke S.W. Sports participation of children with Down’s syndrome // Orthopedic Clinics of North America. 2003. Vol. 34, № 3. P. 439-443.
- American Academy of Pediatrics. Committee on Sports Medicine and Fitness. Atlantoaxial instability in Down syndrome: subject review // Pediatrics. 1995. Vol. 96. P.151-154.
- Doyle J.S., Lauerman W.C., Wood K.B., et al. Complications and long-term outcome of upper cervical spine arthrodesis in patients with Down syndrome // Spine. 1996. Vol. 21. P. 1223–1231.
- Segal L.E., Drummond D.S., Zanotti R.M., et al. Complications of posterior arthrodesis of the cervical spine in patients who have Down syndrome // The Journal of Bone and Joint Surgery. 1991. Vol. 73. P. 1547–1554.
- Smith M.D., Phillips W.A., Hensinger R.N. Fusion for the upper cervical spine in children and adolescents: an analysis of 17 patients // Spine. 1991. Vol. 16, № 7. P. 695-701.
- Lerman J.A., Emans J.B., Hall J.E., et al. Spinal arthrodesis for scoliosis in Down syndrome // Journal of Pediatric Orthopaedics. 2003. Vol. 23, № 2. P. 159-161.
- Roizen N.J., Patterson D. Down’s syndrome // Lancet. 2003. Vol. 12. P. 1281-1289.
- McCance S.E., Smith M.D. Respiratory arrest after anterior cervical discectomy and arthrodesis in a patient with Down syndrome. A case report and review of the literature // The Journal of Bone and Joint Surgery. 1999. Vol. 81, № 12. P. 1741-1743.
- Pallis C., Jones A. M. & Spillane J. D. Cervical spondylosis // Brain. 1954. Vol. 77. P. 274-289.
- Nurick S. The pathogenesis of the spinal cord disorder associated with cervical spondylosis // Brain. 1972. Vol. 95. P. 87-100.
- Tangerud A., Hestnes A., Sand T. & Sunndalsfoll S. Degenerative changes in the cervical spine in Down's syndrome // Journal of Mental Deficiency Research. 1990. Vol. 34. P. 179-185.
- Maclachlan R. A., Fidler K. E., Yeh H., Hodgetts P. G., Pharand G. & Chau M. Cervical spine abnormalities in institutionalized adults with Down's syndrome // Journal of Intellectual Disability Research. 1993. Vol. 37. P. 277-285.
- Fidone G. S. Degenerative cervical arthritis and Down's syndrome // New England Journal of Medicine. 1986. P. 314-320.
- Bosma G.P., et al. Cervical spondylarthrotic myelopathy in Down's syndrome // Journal of Intellectual Disability Research. 1999. Vol. 43, № 4. P. 283-288.
- Dietz F.R., Albanese S.A., Katz D.A., et al. Slipped capital femoral epiphysis in Down syndrome // Journal of Pediatric Orthopaedics. 2004. Vol. 24. P. 508–513.
- Woolf S.K., Gross R.H. Posterior acetabular wall deficiency in Down syndrome // Journal of Pediatric Orthopaedics. 2003. Vol. 23. P. 708–713.
- Bennet G.C., Rang M., Roye D.P., et al. Dislocation of the hip in trisomy 21 // The Journal of Bone and Joint Surgery. 1982. Vol. 64, № 3. P.289-294.
- Boylan M.R., Kapadia B.H., Issa K., Perfetti D.C., Maheshwari A.V., Mont M.A. Down Syndrome Increases the Risk of Short-Term Complications After Total Hip Arthroplasty // The Journal of Arthroplasty. 2016. Vol. 31. P. 368–372.
- Greene W.B. Closed treatment of hip dislocation in Down syndrome // Journal of Pediatric Orthopaedics. 1998. Vol. 18. P. 643–647.
- Diamond L.S., Lynne D., Sigman B. Orthopedic disorders inpatients with Down’s syndrome // Orthopedic Clinics of North America. 1981.Vol. 12, № 1. P. 57–71.
- Staheli L.T.. Practice of Pediatric Orthopedics. Lippincott Williams & Wilkins, 2001. - 788 p.
- Mika G., Gholveb P.A., Scherb D.M., Widmannb R.F., Green D.W. Down syndrome: orthopedic issues // Current Opinion in Pediatrics. 2008. Vol. 20, № 1. P. 30-36.
- Moreira T., Demange M., Gobbi R., Mustacchi Z., Pécora J., Tírico L., Camanho G. Trochlear dysplasia and patellar instability in patients with Down syndrome // Revista Brasileira de Ortopedia. 2015. Vol. 50, № 2. P. 159–163.
- González J.C. Patología del aparato locomotor. En: Corretger JM, Serés A, Casaldàliga J, Trias K (eds). Síndrome de Down. Aspectos médicos actuales. Barcelona: Masson y Fundació Catalana Síndrome de Down, 2005. p. 146-62.
- Escribá A. Síndrome de Down. Propuestas de intervención // Gymnos. 2002. Vol. 9, № 2. P. 434-437.
- Yancy C.L., Zmijewski C., Athreya B.H. Arthropathy of Down’s syndrome // Arthritis & Rheumatism. 1984. Vol. 27. P. 929-934.
- Padmakumar L.G., Evans J., Sills J.A. Is arthritis more common in children with Down syndrome // Rheumatology. 2002. Vol. 41. P. 1191-1193.
- Herring J.A. Cervical instability in Down’s syndrome and juvenile rheumatoid arthritis // Journal of Pediatric Orthopaedics. 1982. Vol. 2. P. 205-207.
- Sherk H.H., Pasquariello P.S., Watters W.C. Multiple dislocations of the cervical spine in a patient with juvenile arthritis and Down’s syndrome // Clinical orthopaedics and related research. 1982. Vol. 162. P. 37-40.
- Juj H., Emery H. The Arthropathy of Down Syndrome: An Underdiagnosed and Under-recognized Condition // The Journal of Pediatrics. 2009. Vol. 154, № 2. P. 234–238.
[1] Правило трех Still: на рентгенограмме в боковой проекции расстояние между задней поверхностью передней дуги первого шейного позвонка и передней поверхностью его задней дуги делят на три равные части. В норме треть этого расстояния занимает зубовидный отросток второго шейного позвонка, треть – спинной мозг, треть отводится на разервное пространство. При наличии нестабильности между первым и вторым шейными позвонками это правило нарушено.
[2] Возможно, у читателя возникнет вопрос: «А если деформация, к примеру, 43 градуса, то какую стратегию лечения выбрать»? Дело в том, что 5 градусов – это предел ошибки измерения. Тактика ведения складывается, исходя из возраста пациента, степени костной зрелости, скорости прогрессирования деформации, уровня развития ребенка, приверженности лечению, а не только от величины – эти цифры условны. Оперируют и 25 градусные сколиозы, равно как и в корсете лечат 80 градусные.