В мире научных исследований в области генетики за последние десятилетия наблюдаются колоссальные достижения благодаря новым возможностям компьютерных технологий. Новые исследования проводятся и в области хромосомных заболеваний с целью изучения влияния генетического дефекта на развитие клинических симптомов. Раскрытие патогенеза этих заболеваний – ключ в разработке таргетных методов лечения. В статье будут освещены исследования, которые были проведены в последнее время и заслуживают внимания, поскольку могут быть первыми шагами в разработке принципиально новых терапевтических подходов лечения пациентов с синдромом Дауна.
Более 50 лет назад была открыта этиологическая причина синдрома Дауна. После того, как стало понятно, что синдром Дауна обусловлен лишней копией 21-й хромосомы, исследователи сфокусировались на определении того, какие гены расположены на ней и какова их роль в развитии клинических симптомов. Большой вклад в понимание этого внесло изучение пациентов с транслокационными формами синдрома Дауна и редкими частичными дупликациями. У этих пациентов в кариотипе может присутствовать лишь часть 21-й хромосомы. И, как результат, в конце прошлого столетия были выделены критические регионы хромосомы 21, изменения числа копий которых обуславливают развитие симптомокомплекса, специфичного для синдрома Дауна. Следом были описаны гены этой хромосомы и их вклад в формирование клинических проявлений. Так, например, стало известно о роли генов CRELD1, FBLN2, FRZB и некоторых других в патогенезе врожденных пороков сердца.

В одном опубликованном в 2019 году [3] исследовании, которое стоит выделить, авторы показали, что повышенная экспрессия гена OLIG2, расположенного на 21-й хромосоме, ведет к развитию интеллектуальной недостаточности. А «выключение» этого гена восстанавливает процесс нормального формирования и функционирования нейронов, синтез медиаторов и синаптическую передачу. Эффекты, возникающие в результате повышенной экспрессии гена OLIG2 у пациентов с синдромом Дауна и после его нокдауна («выключения»), были показаны на органоидах, полученных из клеток пациентов с трисомией. Безусловно, этой работе предшествовал ряд открытий в области биологии и генетики. В первую очередь, важнейшим прорывом явилась возможность получения недифференцированных (плюрипотентных) клеток из любых клеток организма. Благодаря этому стало реальным проведение исследований новыми методами, которые ранее не использовались. Большинство работ осуществлялось на клеточных линиях. Однако клеточные линии – совсем не идеальный объект для изучения, поскольку они не отражают всех процессов, которые могут происходить в целом органе. Выводы, полученные на клеточных линиях, не всегда применимы в отношении целого органа, поскольку орган состоит из различных тканей и не является однородной клеточной массой.
Органоиды – это трехмерные органоподобные клеточные структуры, аналогичные настоящим органам, но значительно уменьшенные в размерах. Вырастить целый орган в искусственных условиях пока невозможно, для этого органоиды помещают в животных, создавая «химеры». Такие модели дают ученым более широкие возможности для изучения патогенеза развития клинических симптомов и последствий различных генетических изменений, в том числе трисомии 21. Органоиды – перспективный объект в разработке новых подходов в лечении наследственных заболеваний. У органоидов есть преимущества и перед животными моделями, поскольку не все, что «работает» у животных, имеет те же результаты у человека в связи с видовыми отличиями.
Пока одни исследователи были сфокусированы на влиянии отдельных генов в развитии тех или иных клинических проявлений, другие реализовывали идею о функциональной коррекции дефекта, лежащего в основе всех трисомных клеток, путем добавления в лишнюю хромосому одного гена, который смог бы заставить ее «молчать». В основу этой идеи лег существующий естественный механизм «выключения» одной из Х хромосом у женщин.
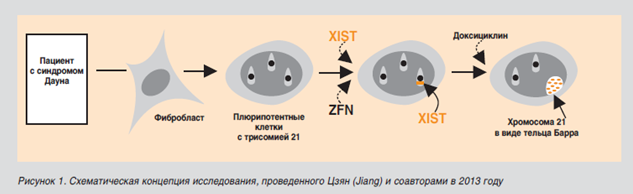
На Х-хромосоме есть ген XIST, который не кодирует РНК, но инактивирует хромосому, и в результате с помощью микроскопа в клетках у женщин мы можем видеть тельце Бара (это и есть инактивированная Х-хромосома). Цзян (Jiang) с соавторами провел исследование на клеточной линии, полученной из фибробластов пациентов с синдромом Дауна [2]. Они добавили ген XIST в лишнюю 21-ю хромосому в определенных условиях и увидели в клетках конденсацию этой хромосомы в виде тельца Бара (рис.1). Таким образом, они инактивировали третью копию, оставив лишь пару 21-х хромосом.
Спустя некоторое время, в 2018 году эта же группа исследователей повторила свой эксперимент. В этот раз они исследовали гемопоэтические и нервные клетки. Они заставили лишнюю хромосому «молчать», благодаря чему значительно улучшились показатели кроветворения и формирования нервных связей.
[2]
Еще одна важная работа, которая была опубликована за последние 5 лет, тоже посвящена тому, как меняется работа генов, расположенных на 21-й хромосоме, а точнее тому, как изменяется белковый гомеостаз (протеостаз) при трисомии 21 [4]. Чжу (Zhu) с соавторами исследовали роль протеостаза в нормальном функционировании головного мозга и при трисомии 21.
Протеостаз является неотъемлемой частью нормальной работы мозга, и на сегодняшний день очень мало данных касательно его роли в патофизиологии синдрома Дауна. Исследователи показали, что интегральный ответ на стресс (ИОС – integrated stress response) – сигнальная сеть, обеспечивающая протеостаз, была избыточно активирована в мозге у животных моделей и пациентов с синдромом Дауна. Эта активация в свою очередь перепрограммирует трансляцию (синтез белков), изменяя протеостаз. Генетическое или фармакологическое подавление ИОС путем некоторых биологических механизмов обращает вспять возникшие изменения трансляции и нарушения синаптической передачи и синаптической пластичности в головном мозге. Подавление чрезмерной активации ИОС у мышиных моделей в конечном счете улучшило их долговременную память. Таким образом, авторы показали, что ИОС играет важнейшую роль в патогенезе неврологических нарушений при синдроме Дауна. И они предполагают, что регулировка ИОС может стать основой нового терапевтического подхода коррекции когнитивных и неврологических нарушений при трисомии 21.
Безусловно, все эти работы, проведенные на клеточных линиях и животных моделях, еще очень далеки от создания медицинских препаратов. Возможно, потребуются годы, прежде чем мы получим готовые лекарства, предотвращающие развитие характерных для синдрома Дауна нарушений. Тем не менее уже сделаны очень важные шаги в разработке принципиально новых методов специализированного лечения и в персонализированной медицине.
Список используемой литературы:
- Chiang, J.-C., Jiang, J., Newburger, P. E., & Lawrence, J. B. (2018). Trisomy silencing by XIST normalizes Down syndrome cell pathogenesis demonstrated for hematopoietic defects in vitro. Nature Communications, 9(1). doi:10.1038/s41467-018-07630-y.
- Jiang, J., Jing, Y., Cost, G. J., et al. (2013). Translating dosage compensation to trisomy 21. Nature, 500(7462), 296–300. doi:10.1038/nature12394.
- Xu, R., Brawner, A. T., Li, S., Liu, J.-J., et al. (2019). OLIG2 Drives Abnormal Neurodevelopmental Phenotypes in Human iPSC-Based Organoid and Chimeric Mouse Models of Down Syndrome. Cell Stem Cell, 24(6), 908-926.e8. doi:10.1016/j.stem.2019.04.014.
- Zhu, P.J. et al., (2019). Activation of the ISR mediates the behavioral and neurophysiological abnormalities in Down syndrome. Science, 366(6467), pp.843–849. Available at: http://dx.doi.org/10.1126/science.aaw5185.


.jpg)
.jpg)




.jpg)